摘要

关键词
- 钙感受受体 (Calcium-sensing receptor, CaSR)
- G蛋白选择性 (G-protein selectivity)
- 变构调节 (Allosteric modulation)
- 低温电子显微镜 (Cryo-electron microscopy, Cryo-EM)
- 自旋轨道耦合 (Spin–orbit coupling)
- 配体特异性 (Ligand specificity)
研究背景
钙感受受体 (CaSR) 是一种检测血清钙浓度并调节副甲状腺激素 (PTH) 分泌和肾脏钙排泄的关键分子。它在慢性肾病、家族性低尿钙性高钙血症等多种疾病中扮演重要角色。作为家族C GPCR的一员,CaSR具有独特的配体结合和G蛋白耦合特性。然而,CaSR如何实现对不同G蛋白 (Gi和Gq) 的选择性,以及天然和外源性配体如何通过变构机制调节CaSR功能,尚未完全清楚。本研究通过冷冻电镜和生物化学方法揭示了CaSR与G蛋白的相互作用及其活化机制。
创新点
- 首次解析了CaSR与Gi和Gq蛋白的高分辨率复合物结构。
- 阐明了CaSR的G蛋白选择性来源于7TM和胞内环的独特构象变化。
- 揭示了多胺和外源性变构调节剂 (如cinacalcet) 在CaSR活化中的关键作用。
研究内容
本研究通过冷冻电镜解析了嵌入脂质纳米盘中的CaSR与Gi和Gq蛋白的复合物结构,并结合功能实验探讨其变构调节和G蛋白选择性机制。研究发现,CaSR通过胞内环 (ICL2) 和C末端的构象变化,与不同G蛋白形成特异性结合界面。Gi蛋白的结合伴随着TM3和ICL3区域的有序化,而Gq蛋白的结合则涉及C末端的构象重排。此外,研究表明,天然多胺如spermine通过稳定负电荷区域增强了CaSR的活性,而外源性变构调节剂cinacalcet通过诱导7TM的构象变化促进了G蛋白耦合。实验还揭示了CaSR在Gi和Gq蛋白结合状态下的7TM不对称性,以及不同配体如何在7TM中发挥调控作用。

(a) 结合 Cinacalcet (CINA) 的活化态 CaSR 冷冻电镜图像。
(b) 脂质纳米盘中的 CaSR–Gi 复合物冷冻电镜图像。
(c) 脂质纳米盘中的 CaSR–Gq 复合物冷冻电镜图像。
(d-e) 在 CINA 结合的 CaSR–Gi 结构中,7TM 的非对称构型和二聚体界面。两个平行于膜平面的视图展示了顶部 (d) 和底部 (e) 磷脂层以及胆固醇的位置。
(f) CaSR–Gi 复合物与活化态 CaSR (CaSR*) 的结构对比,显示两个 7TM 束的进一步压缩。
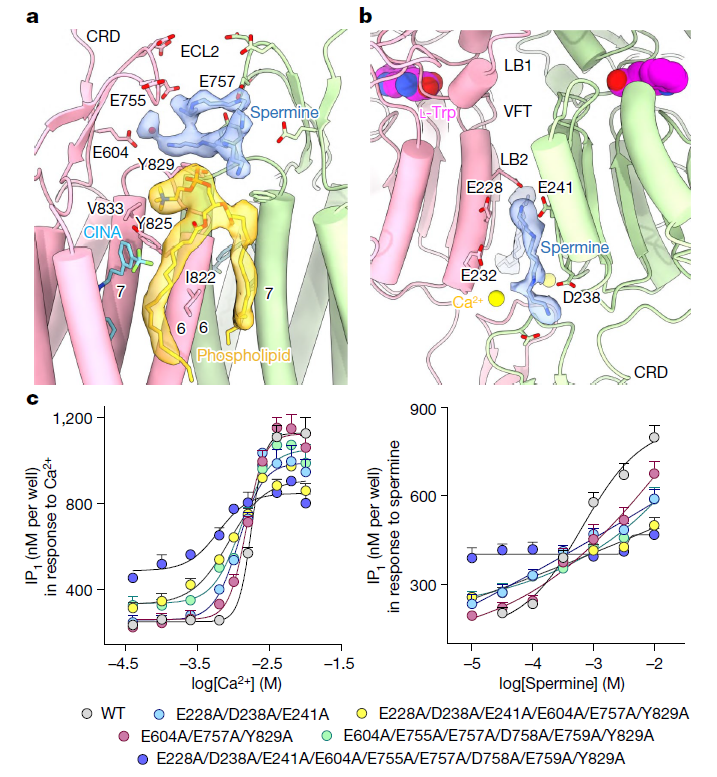
(a) 在 CINA 结合的 CaSR–Gi 复合物中,两个 Spermine 分子结合在 ECL–CRD 区域。图像显示了 Spermine 和磷脂的冷冻电镜密度,水分子(红色球体)位于 CRD 的 E604 和下方的 Spermine 分子之间。
(b) 在 CINA 结合的 CaSR–Gi 复合物中,Spermine 分子位于两个原型的 LB2 叶之间的结合位点。
(c) 通过突变分析 Spermine 结合位点。IP1 累积实验表明,与野生型(WT)相比,特定 CaSR 突变体对 Spermine 的功能性响应减弱。
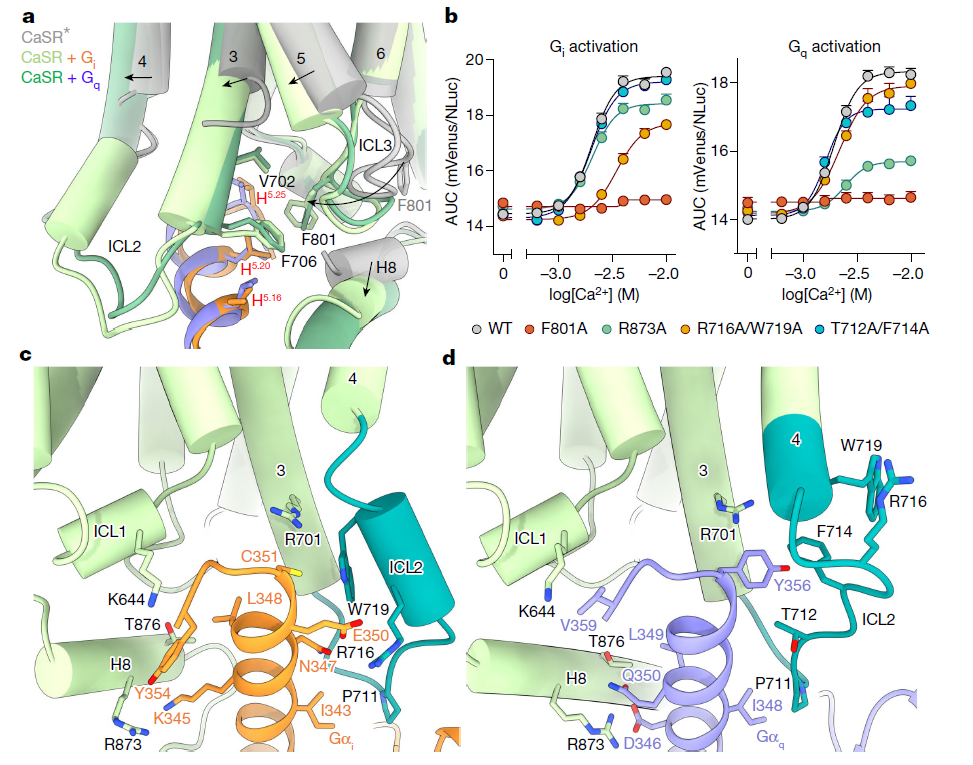
(a) 活化态 CaSR 与 Gi 和 Gq 结合态的 7TM 束细胞内区域对比,显示 G 蛋白结合后 ICL2 和其他细胞内区域的结构重排。
(b) 基于 BRET 的 G 蛋白激活实验,识别在 ICL2 和 H8 中对 Gi 和 Gq 激活重要的残基。
(c) 在 CINA 结合的 CaSR–Gi 复合物中,ICL2、TM3 和 H8 与 Gαi 的 α5 螺旋的相互作用。
(d) 在 CINA 结合的 CaSR–Gq 复合物中,ICL2、TM3 和 H8 与 Gαq 的 α5 螺旋的相互作用。
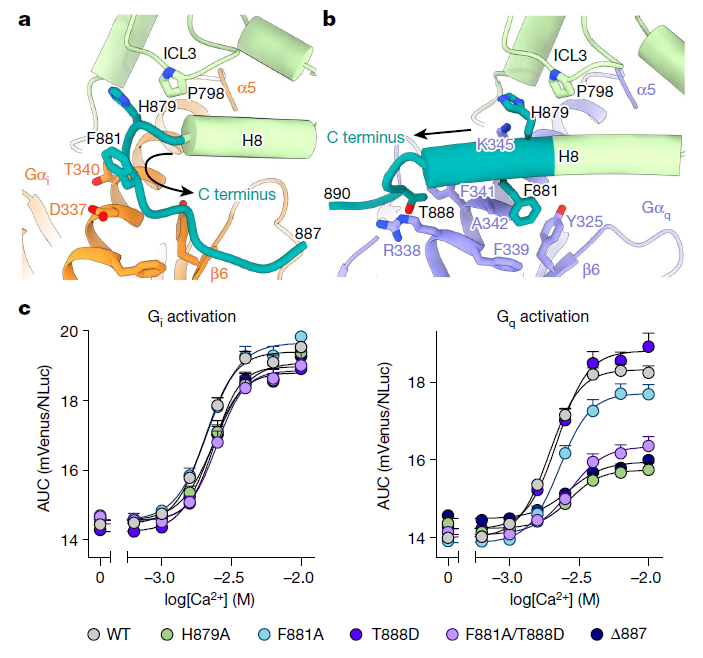
(a) 在 CINA 结合的 CaSR–Gi 复合物中,C 端与 Gαi 的相互作用界面,C 端(残基 878–887)显示为环状结构,方向由箭头指示。
(b) 在 CINA 结合的 CaSR–Gq 复合物中,C 端与 Gαq 的相互作用界面,C 端(残基 878–890)显示为 H8 延伸结构,方向由箭头指示。
(c) 基于 BRET 的功能性 G 蛋白激活实验显示,CaSR C 端中与 Gαq 结合的关键残基对 Gq 激活至关重要,但对 Gi 激活影响较小。
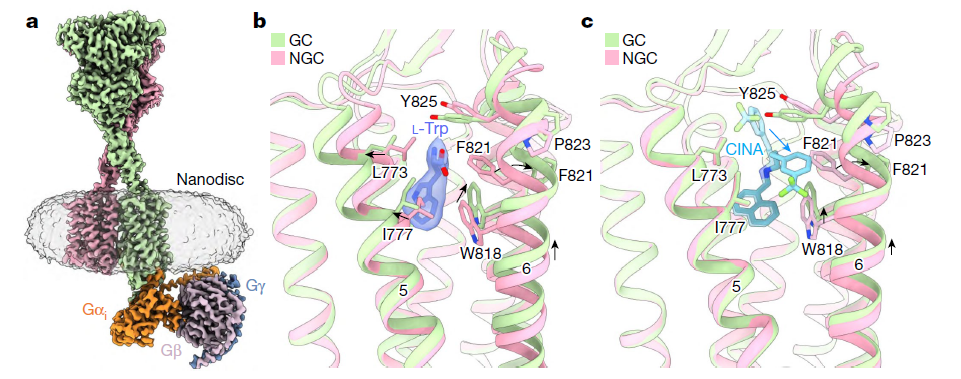
(a) 脂质纳米盘中无 PAM 的 CaSR–Gi 复合物冷冻电镜图像。
(b) 无 PAM 的 CaSR–Gi 复合物中 7TM 的构型差异,显示 Trp 结合后 TM5 和 TM6 的运动。
(c) CINA 结合的 CaSR–Gi 复合物中 7TM 的构型差异,显示 CINA 结合诱导的 TM5 向外位移。
结论与展望
本研究首次揭示了CaSR的G蛋白选择性及其变构调节机制,指出了CaSR通过ICL2和C末端的构象变化实现对Gi和Gq蛋白的特异性耦合。研究还表明,多胺和变构调节剂通过稳定受体结构或诱导构象变化增强了CaSR活性。未来研究可进一步探索CaSR的配体特异性及其在疾病治疗中的潜力,特别是通过优化变构调节剂设计以实现特定G蛋白通路的选择性调控。
论文直达
原文标题:Allosteric modulation and G-protein selectivity of the Ca2+-sensing receptor
Nature 2024, 626, 1141–1148.
点击以下链接阅读原文:

