摘要

关键词
- 免疫细胞 (Immune cells)
- 细胞交互 (Cell interactions)
- uLIPSTIC技术 (uLIPSTIC technology)
- 单细胞转录组学 (Single-cell transcriptomics)
- T细胞 (T cells)
- 抗原递呈细胞 (Antigen-presenting cells)
研究背景
细胞之间通过膜结合分子进行的物理交互是多种组织功能的核心,尤其在免疫系统中,交互对于T细胞的激活、B细胞的抗体生成等起着关键作用。然而,传统的显微成像技术无法回收交互的细胞以供进一步分析,难以揭示交互对细胞行为的影响。基于空间转录组学和高密度成像技术的研究也多依赖细胞邻近性,而非真实的物理交互。为此,本研究开发了一种无需依赖特定受体或配体的通用标记方法uLIPSTIC,结合单细胞RNA测序,实现对细胞交互的全面定量分析。
创新点
- 提出了一种通用的细胞交互记录技术,突破了传统方法对特定受体-配体的依赖。
- 结合单细胞转录组学,首次实现了细胞交互相关基因表达的量化研究。
- 揭示了免疫细胞与非免疫细胞在稳态及感染条件下的交互网络。
研究内容
本研究开发的uLIPSTIC技术,通过将标记酶SrtA和受体G5锚定在细胞膜上,在细胞间达到接近14 nm的距离时完成标记转移。实验表明,该技术能够记录CD8+ T细胞和树突状细胞的初始交互,描述了肠上皮细胞与免疫细胞的稳态交互图谱,并揭示了病毒感染后T细胞与单核细胞间的动态变化。结合单细胞RNA测序,uLIPSTIC可以量化细胞交互的强度,并关联基因表达的变化,从而解析特定交互的分子机制。
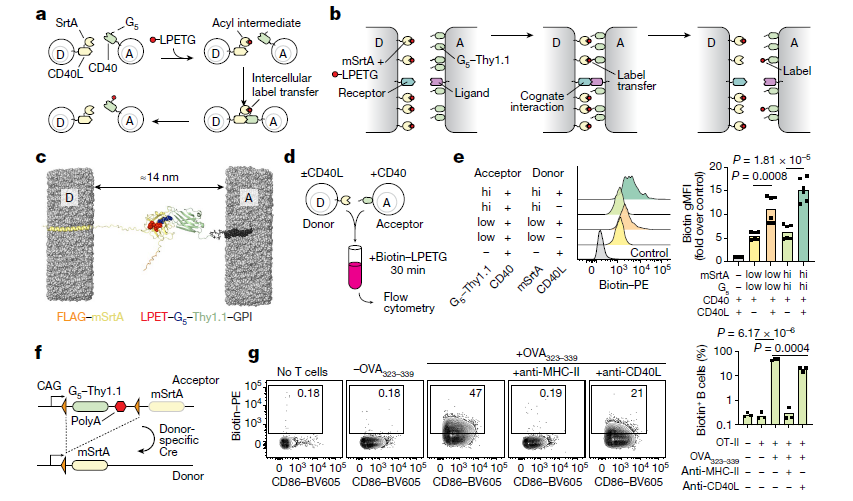
(a, b) 原始LIPSTIC系统 (a) 和uLIPSTIC系统 (b) 的示意图比较。在原始系统中 (a),通过与细胞–细胞相互作用相关的受体–配体对融合,SrtA和G5靠近在一起,从而允许标记底物(LPETG)从供体(D)细胞转移到受体(A)细胞。在uLIPSTIC系统 (b) 中,SrtA和G5(与不相关蛋白Thy1.1融合)非特异性地锚定在细胞膜上并以高密度表达;当相对的膜彼此接近到小于14纳米的短距离时,酶促反应即可进行,此过程可由任何尺寸合适的受体–配体对驱动。
(c) 计算模型显示,完全延伸的mSrtA在将LPETG底物转移到G5–Thy1.1后跨越的膜间距离。
(d) 293T细胞群体被共同转染高或低水平的mSrtA或G5–Thy1.1,并在存在生物素–LPETG的条件下共孵育30分钟,随后进行流式细胞术分析。
(e) 直方图显示(d)中处理后受体细胞的标记程度。柱状图中的每个符号代表一个技术重复,数据来自两次独立实验的汇总。gMFI表示几何平均荧光强度。
(f) Rosa26uLIPSTIC小鼠等位基因。在高表达Ai9骨架的基础上,loxP(橙色三角形)夹有G5–Thy1.1编码序列,后接mSrtA编码序列。Cre重组酶可将细胞从“受体”(G5–Thy1.1+)模式切换为“供体”(mSrtA+)模式。
(g) Rosa26uLIPSTIC/+ .CD4-Cre OT-II供体T细胞与Rosa26uLIPSTIC/+受体B细胞在存在或不存在OVA323–339肽和CD40L及MHC-II阻断抗体的条件下共同培养。流式细胞术图(左),在B细胞门中,显示了生物素–LPETG从T细胞向B细胞的转移;数字表示在门控群体中标记的B细胞百分比。柱状图(右)中的每个符号代表来自三次独立实验的一个生物学重复。
对于(e, g),P值使用双尾Student’s t检验计算。
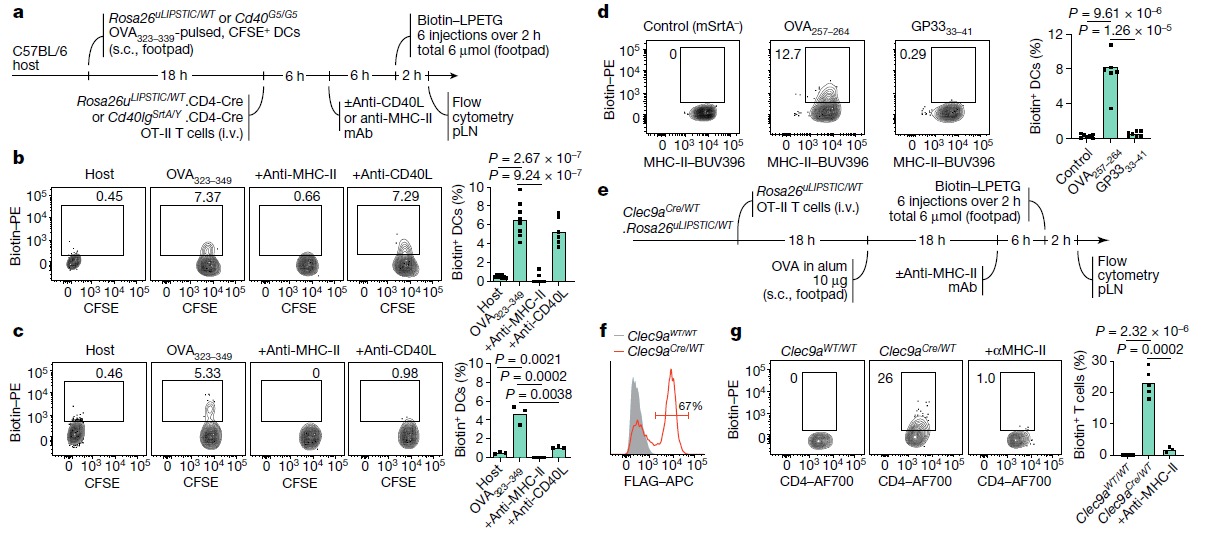
(a) 实验流程用于(b, c)中的实验。s.c.表示皮下注射;mAb表示单克隆抗体。
(b, c) 在体内诱导模型中,uLIPSTIC (b) 和CD40L LIPSTIC (c) 对移植的DC的标记。流式细胞术图(左)针对移植的(CFSE标记的)DC进行门控。右侧柱状图总结了DC的标记程度。
(d) uLIPSTIC标记CD8+ T细胞对DC的作用。实验设置与(a)相同,但DC分别用同源肽(OVA257–264)或对照肽(LCMV GP333–341)预处理,并与Rosa26uLIPSTIC/WT.CD4-Cre OT-I CD8+供体T细胞或对照mSrtA–Rosa26uLIPSTIC/WT OT-I CD8+ T细胞共同转移。DC的标记情况总结在柱状图中。
(e–g) Clec9a表达的DC标记抗原特异性CD4+ T细胞的实验。
(e) 实验流程示意图。i.v.表示静脉注射。
(f) 通过Clec9aCre测量迁移性DC中FLAG-mSrtA表达细胞的重组效率(百分比)。
(g) 左:在铝佐剂中免疫OVA后,标记移植的OT-II T细胞的结果。右:数据总结柱状图。
所有柱状图中显示的结果来自两次独立实验,每个符号代表一只小鼠。所有流式细胞图中的数字表示门控群体中细胞的百分比。P值使用双尾Student’s t检验计算。
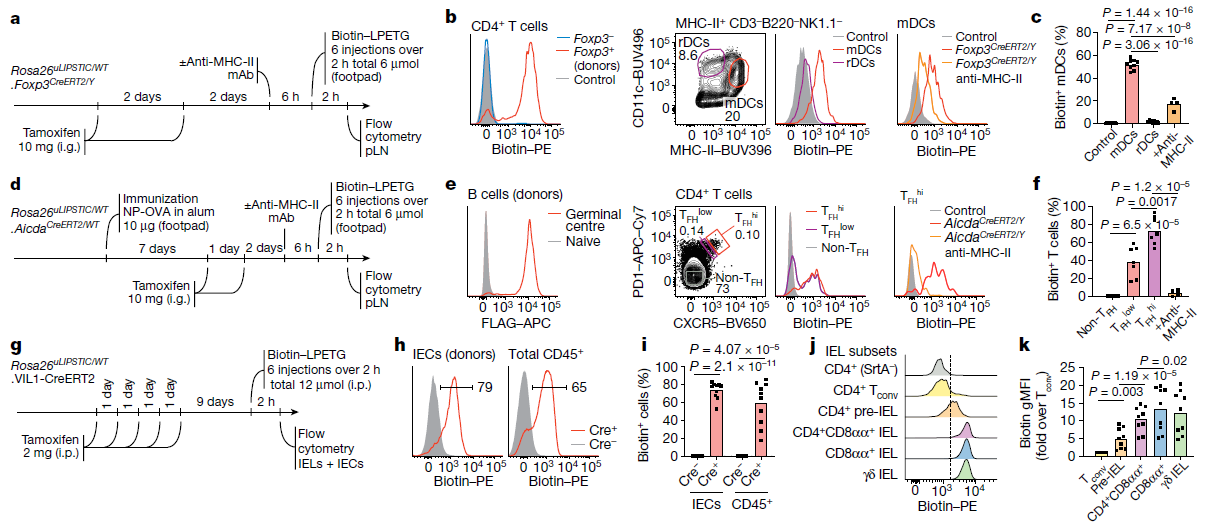
(a) 实验流程用于 (b, c) 中的实验。i.g. 表示胃内注射。
(b) 左:通过Foxp3CreERT2在Treg细胞中实现uLIPSTIC等位基因重组的效率。生物素信号表示Treg细胞获取底物(标记生物素的LPET负载SrtA酰基中间体),并显示底物未转移到Foxp3⁻ T细胞。中:在稳态下Treg细胞标记迁移性DC (mDC) 和驻留性DC (rDC) 的结果。右:注射MHC-II阻断抗体后mDC的标记结果。
(c) 来自三次独立实验的数据总结。
(d) 实验流程用于 (e, f) 中的实验。
(e) 生发中心B细胞标记TFH细胞。左:通过AicdaCreERT2在生发中心B细胞中实现uLIPSTIC等位基因重组的效率(与b中相同的实验中,给予两剂他莫昔芬)。中:在免疫NP-OVA(铝佐剂)10天后,生发中心B细胞标记TFH细胞的结果。T细胞按TFH标志物CXCR5和PD1的高表达 (TFHhi) 和低表达 (TFHlow) 进行门控。右:注射MHC-II阻断抗体后TFHhi细胞的标记结果。
(f) 来自两次独立实验的数据总结。
(g) 实验流程用于 (h–k) 中的实验。
(h) 左:在VIL1CreERT2小鼠中小肠上皮细胞 (IECs) 转化为uLIPSTIC供体和捕获底物的效率(与b中相同)。右:标记总CD45+上皮内淋巴细胞 (IEL)。
(i) 来自三次独立实验的数据总结。
(j) IEC供体对特定IEL群体的差异性标记。虚线用作参考。
(k) 来自三次独立实验的生物素几何平均荧光强度的总结柱状图。
对于所有柱状图,每个符号代表一只小鼠;误差条表示均值。所有流式细胞图和直方图中的数字表示门控群体中细胞的百分比。P值使用双尾Student’s t检验计算。
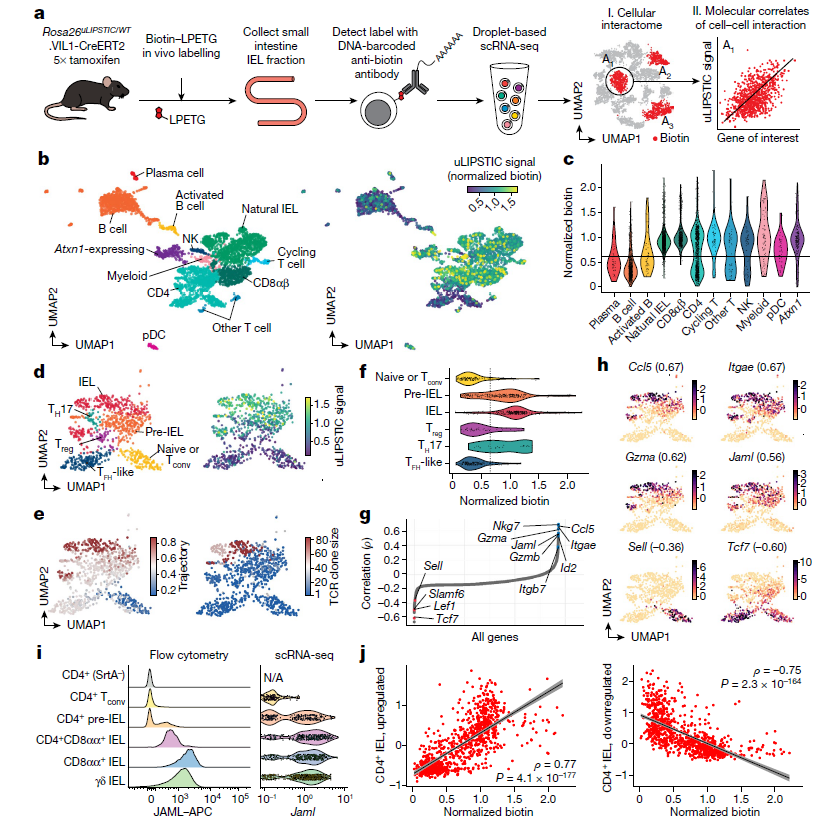
(a) 实验流程图。
(b) 使用与图3g中相同的uLIPSTIC反应,从CD45+上皮内免疫细胞群体获取的统一流形近似投影 (UMAP) 图。数据来自三只小鼠。左:主要细胞群体(参见扩展数据图6和图7)。NK,自然杀伤细胞;pDC,浆细胞样树突状细胞。右:标准化的uLIPSTIC信号(以对数标度的任意单位表示)。
(c) CD45+细胞群体中标准化的uLIPSTIC信号。虚线表示被视为受体的细胞阈值,基于标准化生物素的整体分布。
(d) 从(b)中获取的CD4+ T细胞的UMAP图,n = 915个细胞。左:主要细胞亚群(参见扩展数据图8)。右:标准化的uLIPSTIC信号。
(e) CD4+ T细胞的推断轨迹图(左)和αβTCR多样性(以克隆大小表示;右)。
(f) CD4+ T细胞亚群中标准化的uLIPSTIC信号。
(g) Spearman相关性 (ρ) 显示标准化uLIPSTIC信号与标准化基因表达之间的相关性,计算基于所有CD4+ T细胞中每个基因的表达水平,按相关性递增顺序显示。显著相关的选定基因(假发现率 <1 × 10⁻²³)被突出显示。
(h) 选定基因的标准化表达水平。括号中显示与标准化uLIPSTIC信号的相关性。
(i) 代表性样本显示了体内对IELs中JAML的染色,以及在scRNA-seq中等效群体中Jaml的表达。在后者中,通过αβ TCR重排的存在或Trdc基因的表达将CD8αα+ 和γδ IEL从“自然IEL”簇中分离。
(j) 所有CD4+ T细胞中标准化uLIPSTIC信号与基因特征的关系,这些基因在上皮T细胞从Tconv(CD4+CD103⁻CD8αα⁻)向CD4+ IEL(CD4+CD103+CD8αα+)表型转变过程中分别上调和下调(基因特征基于参考文献6的数据)。趋势线和误差为线性回归的95%置信区间;列出了Spearman相关性系数ρ和双侧P值。
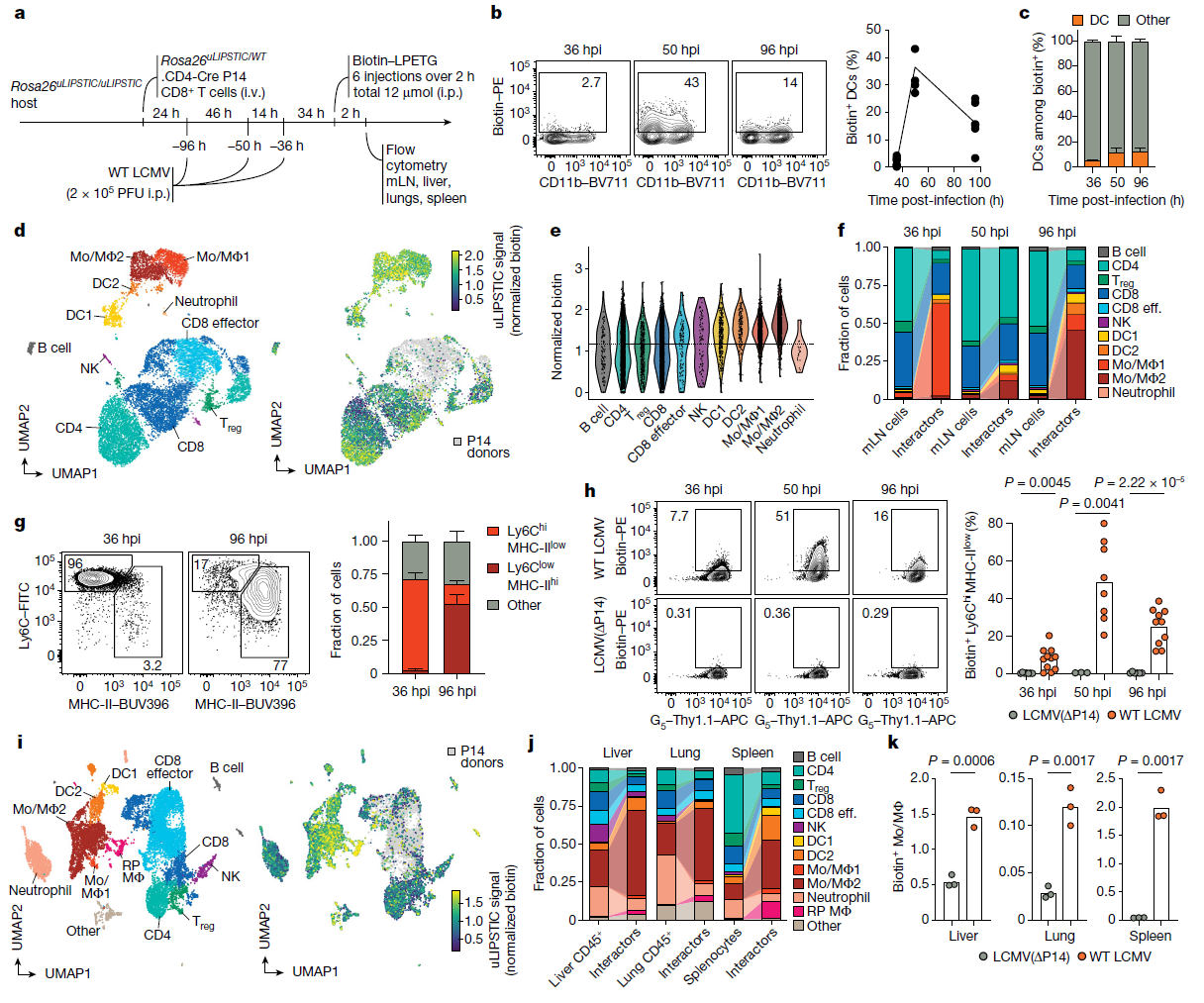
(a) 实验流程示意图。PFU表示病毒斑形成单位。
(b) 左:在指定时间点由P14细胞标记的DC。右:来自三次独立实验的WT LCMV数据总结。
(c) 流式细胞术确定在生物素阳性受体细胞中DC的比例。数据来自三次独立实验中每个时间点的六只小鼠。
(d) 使用UMAP图对mLN细胞进行可视化,细胞根据(a)中的方法分选。数据汇总自感染后36、50和96小时(hpi),每个时间点来自2–3只小鼠。细胞经过uLIPSTIC受体富集并去除B细胞(详见扩展数据图9c)。左:主要细胞类型注释(参见扩展数据图9g–i)。右:标准化uLIPSTIC信号(生物素),排除供体P14细胞。
(e) 在所有细胞群体(排除供体P14细胞)中的标准化uLIPSTIC信号。虚线表示根据标准化生物素的总体双峰分布确定的受体细胞阈值。
(f) 与(d)中相同的细胞类型分布,比较总mLN细胞与生物素阳性受体细胞(排除P14供体)的分数。eff. 表示效应细胞。
(g) 左:在指定时间点uLIPSTIC标记的单核细胞(Mo/MΦ)分布。右:标记的单核细胞亚群在所有uLIPSTIC标记受体细胞中的比例。数据来自一次实验中每个时间点的四只小鼠。
(h) 左:感染WT LCMV或LCMV(ΔP14)后,在指定时间点标记的Ly6Chi单核细胞(Mo/MΦ1)。右:来自三次独立实验的数据量化。
(i) 与(d)相同,但数据来自感染96小时后的肝脏、肺和脾脏的汇总样本。RP表示红髓。
(j) 与(f)相同,但数据来自感染96小时后的肝脏、肺和脾脏的汇总样本。
(k) 在感染WT LCMV或LCMV(ΔP14)的小鼠器官中分析MHC-IIhi单核细胞或巨噬细胞(Mo/MΦ2)的uLIPSTIC标记情况,分析时间为96 hpi。数据来自一次实验。
(c, g) 中的柱状图显示均值 ± 标准误差(s.e.m.)。在(b, h, k) 中,每个符号代表一只小鼠,P值使用双尾Student’s t检验计算。
结论与展望
uLIPSTIC提供了一种无需预先定义受体-配体对的通用标记方法,结合单细胞转录组学,为细胞交互研究开辟了新的路径。未来,该技术可广泛应用于免疫学和其他生物学领域,帮助发现更多未知的细胞交互模式及其分子机制。
论文直达
原文标题:Universal recording of immune cell interactions in vivo
Nature, 2024, 627, 399–406.
点击以下链接阅读原文:

