摘要

关键词
- 核糖体转位 (Ribosome translocation)
- 阅读框维护 (Reading frame maintenance)
- 真核延长因子2 (Eukaryotic elongation factor 2, eEF2)
- 冻电镜 (Cryo-EM)
- 二酰胺 (Diphthamide)
- 转译精确性 (Translational fidelity)
研究背景
在蛋白质合成过程中,mRNA和tRNA通过核糖体的同步转位完成翻译框架的推进。然而,阅读框移位可能导致错误的蛋白质翻译,严重影响细胞功能。尽管细菌核糖体的转位已被深入研究,但由于真核80S核糖体的复杂性,相关研究一直难以实现高分辨率解析。本研究通过冷冻电镜首次获得了真核转位全过程中的多种中间态,全面揭示了真核核糖体如何通过eEF2及其独特的二酰胺修饰实现高精度的转位,并展示了这一过程对翻译抑制剂sordarin的敏感性。
创新点
- 解析了真核核糖体转位全过程的10种高分辨率中间结构。
- 揭示了真核延长因子2(eEF2)及其二酰胺修饰在阅读框维护中的核心作用。
- 阐明了抗真菌药物sordarin通过结合eEF2干扰核糖体转位的机制。
- 强调了真核特异性核糖体修饰对转译精确性的贡献。
研究内容
本文利用冷冻电镜对真核酿酒酵母核糖体的转位过程进行了系统解析,获得了10种代表性中间结构。这些结构覆盖了从eEF2初始结合至转位完成的全过程,分辨率最高达1.97 Å。研究发现,eEF2通过其IV域的二酰胺修饰与mRNA和tRNA形成多重氢键,特别是稳定了tRNA的密码子–反密码子对,防止阅读框移位。此外,研究还显示sordarin通过限制eEF2的构象变化阻止其从核糖体释放,从而引发转位阻滞。实验数据揭示了真核核糖体在转位过程中通过大规模构象变化实现了mRNA-tRNA模块的精确推进,并提出了二酰胺在转译校对中的重要作用。
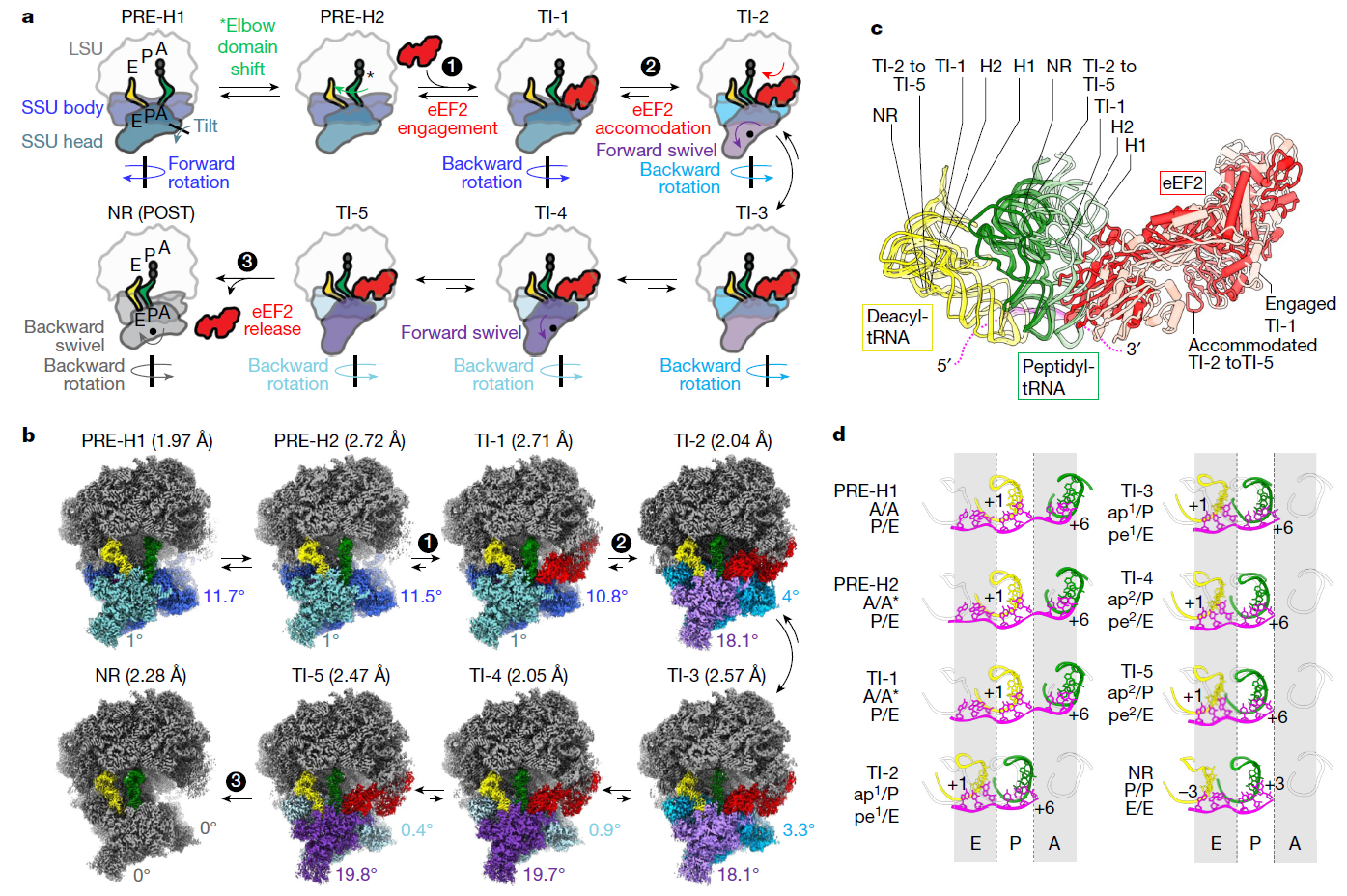
(a) 基于本研究中高分辨率冷冻电镜重建的80S核糖体延伸复合物示意图。eEF2催化肽酰-tRNA(绿色)和脱酰化tRNA(黄色)从A到P位点和从P到E位点的位移,与小亚基(SSU)体部的回旋(深蓝到灰色)、SSU头部的前旋(蓝紫到紫色)和后旋(紫色到灰色)相关联。eEF2用红色表示,大亚基(LSU)为灰色,二肽用深灰色显示。
(b) 本研究中报告的分辨率和冷冻电镜图像概览,与(a)中的配色一致。
(c) LSU对齐显示了从PRE-H1到NR的tRNA转移轨迹,使用从浅到深的色板表示。TI-1显示了eEF2的招募阶段(粉色),而晚期TI(TI-2到TI-5)反映了其在核糖体上的完全适应状态,例如TI-5(红色)。mRNA以洋红色表示。
(d) 相对于PRE-H1(A位点)和NR状态(P和E位点),展示了密码子–反密码子双链的推进情况。对齐基于SSU体部完成。
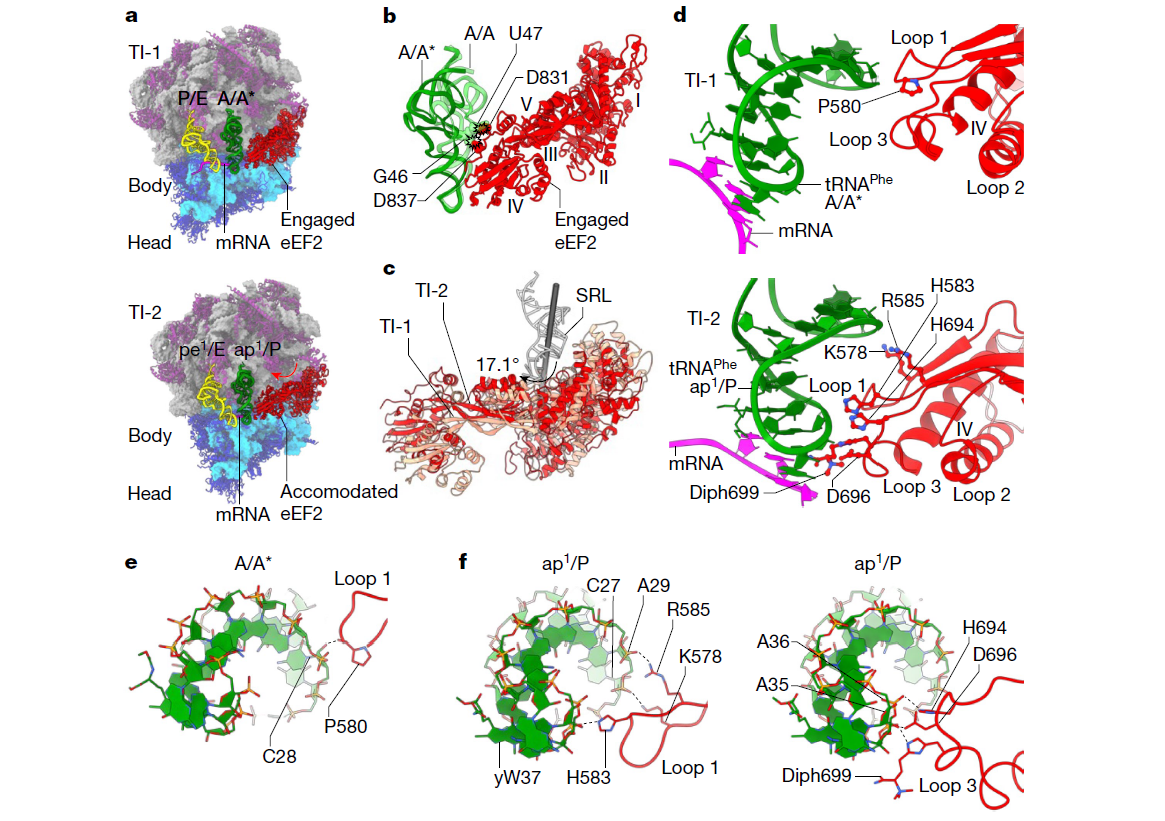
(a) TI-1(上图)和TI-2(下图)的概览,包括肽酰-tRNA(绿色)、脱酰化-tRNA(黄色)、eEF2(红色)和mRNA(洋红色)。eEF2在80S核糖体上的适应(红色箭头)与tRNA从混合A/A*-P/E状态到嵌合ap1/P-pe1/E状态的推进相关。
(b) 肽酰-tRNA肘部从A/A(浅绿色)到A/A*(绿色)的位移是eEF2在80S核糖体上结合的必要条件。经典A/A状态下的肽酰-tRNA与eEF2 IV结构域发生碰撞的残基以球模型显示。
(c) eEF2围绕SRL的旋转,在其从结合到适应状态的过渡中发生。
(d) eEF2 IV结构域在TI-1(上图)和TI-2(下图)中稳定肽酰-tRNA的ASL的残基。
(e, f) eEF2 IV结构域的各个回路与肽酰-tRNA ASL在TI-1(e)和TI-2(f)中的相互作用。
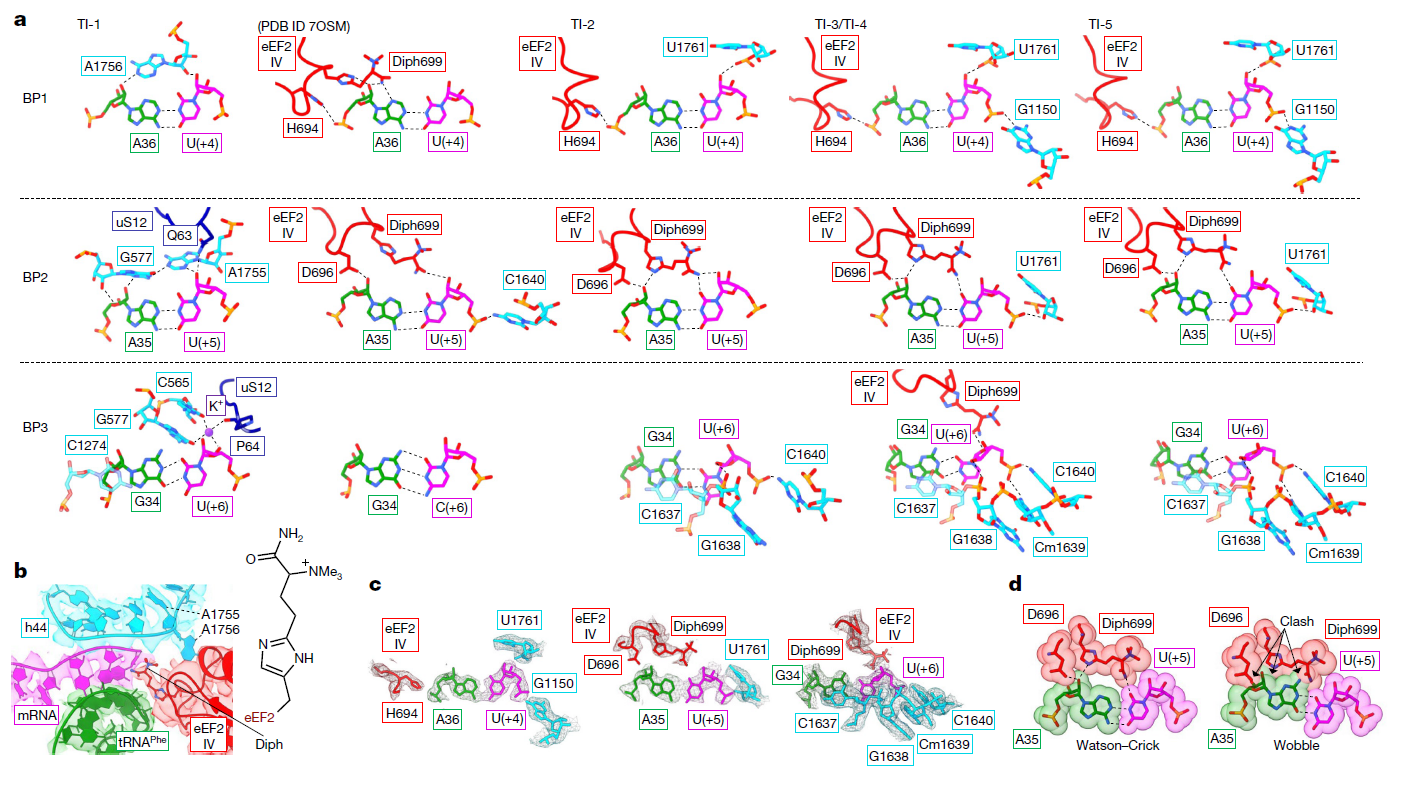
(a) 在TI-1到TI-5以及之前报道的早期TI中,观察到eEF2 IV结构域(红色)、18S rRNA(浅蓝色)和SSU蛋白uS12(深蓝色)与密码子–反密码子碱基对的相互作用网络。
(b) eEF2 IV结构域的白喉酰胺(Diph)与SSU螺旋h44(浅蓝色)附近的UUU密码子(洋红色)和fMet-Phe-N-tRNAPhe的GAA反密码子(绿色)的稳定作用。
(c) TI-4复合物中BP1–BP3及其相互作用残基的冷冻电镜密度实例,等高线为σ = 3。
(d) eEF2 IV结构域的白喉酰胺和天冬氨酸残基对密码子–反密码子BP2施加空间限制,抑制了摇摆构型。
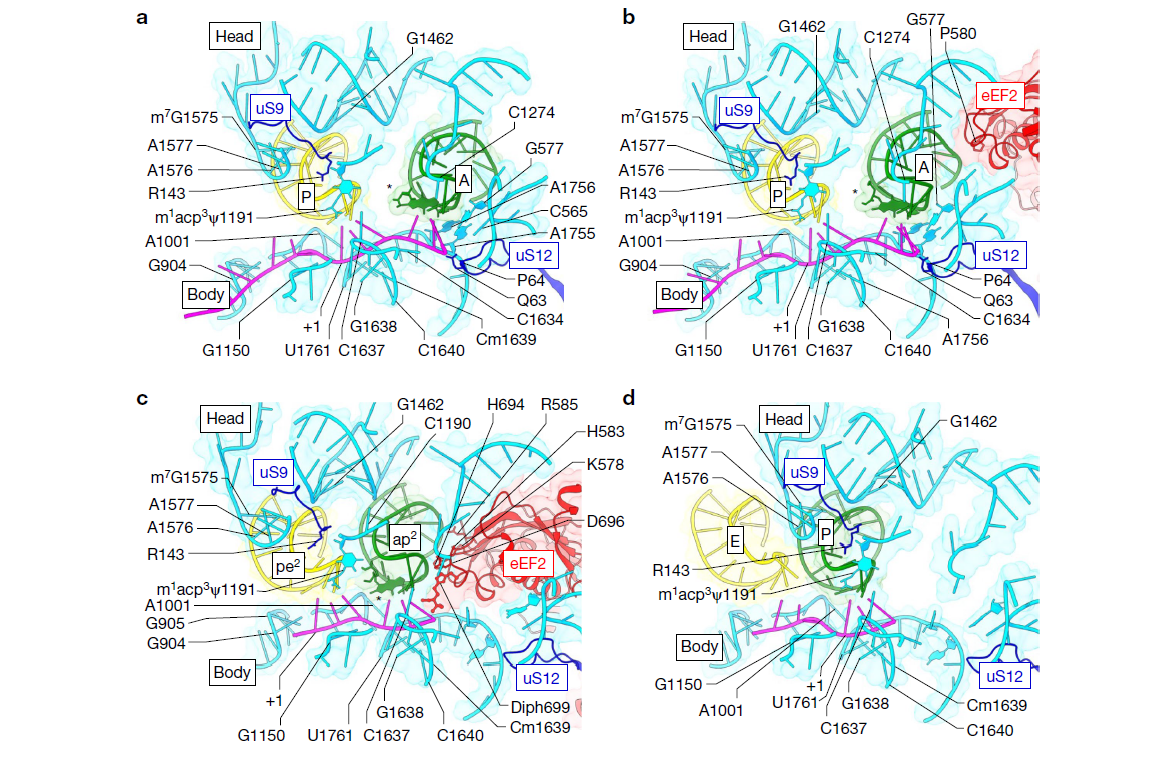
(a-d) 展示了mRNA(洋红色)及肽酰-tRNA(绿色)和脱酰化-tRNA(黄色)的ASL与eEF2 IV结构域(红色)以及SSU体部和头部的相互作用(18S rRNA为浅蓝色,SSU蛋白为深蓝色)。
(a) PRE-H1状态下的mRNA–tRNA2模块运动。
(b) TI-1状态下的相互作用。
(c) TI-4状态下的嵌合态mRNA–tRNA2运动。
(d) NR状态下的相互作用,tRNAPhe超修饰wybutosine(yW)位于37位。
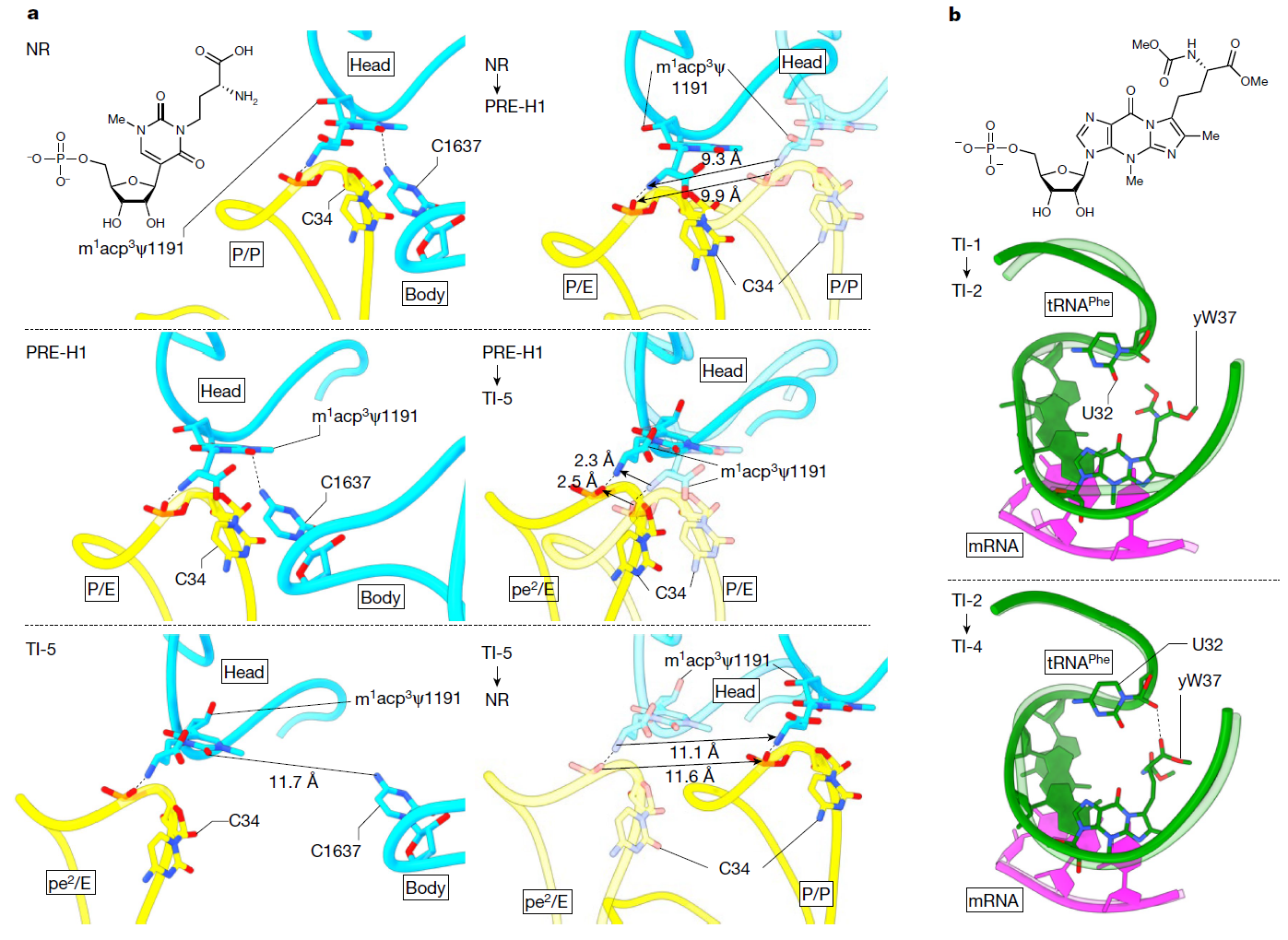
(a) 超修饰m1acp3Ψ1191与脱酰化-tRNAfMet的第一反密码子核苷酸C34之间的氢键相互作用,在NR、PRE-H1和TI-5状态下展示。
(b) yW37的体积链在TI-4状态下延伸到ASL内部,与U32形成氢键,显示了tRNAPhe ASL的构象重塑。
结论与展望
本文通过高分辨率结构解析揭示了真核核糖体在转位过程中的mRNA阅读框维护机制,展示了真核延长因子2(eEF2)及其二酰胺修饰在这一过程中不可或缺的作用。此外,研究还揭示了抗真菌药物sordarin对核糖体转位的影响,为开发新的翻译抑制剂提供了分子依据。未来研究将聚焦于通过时间分辨冷冻电镜进一步解析核糖体转位的动力学过程,并探索其在病理和药物开发中的潜力。
论文直达
原文标题:mRNA reading frame maintenance during eukaryotic ribosome translocation
Nature 2024, 625, 393–400.
点击以下链接阅读原文:

